Перевод статьи CO2 in planted aquaria.
Оле Педерсен (Ole Pedersen), Троелс Андерсен (Troels Andersen) и Клаус Кристенсен (Claus Christensen).
Эта статья впервые была опубликована в журнале The Aquatic Gardener 2007 том. 20 (3) стр. 24-33 (PDF)
Публикуется на условиях Tropica свободного некоммерческого использования.
Перевод - ©Руслан Иванюшин (a.k.a. naman) 2007.
CO2 вне всякого сомнения самый важный среди всех источник питания. Без достаточного количества СО2 растения не могут фотосинтезировать и преобразовывать неорганический углерод в богатые энергией сахара, крахмал и все остальные молекулы содержащие углерод составляющие растение. Может показаться странным рассматривать СО2 как источник питания растений. При выращивании наземных растений мы предоставляем свет, воду, питательные вещества, но никогда CO2. Эта статья разъясняет почему в аквариум нужно дополнительно подавать CO2, как СО2 используется растениями, как мы можем предоставить CO2, и сколько его нужно.
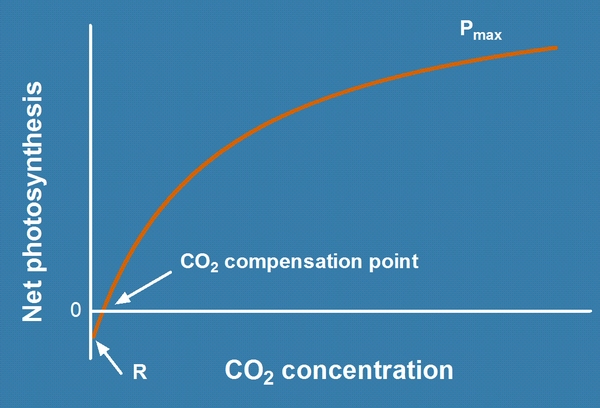 | Фотосинтез как функция концентрации CO2.
При очень низкой концентрации СО2 общий фотосинтез имеет негативный баланс. Точка компенсации СО2 (CO2 compensation point) определена как точка в которой общий фотосинтез равен нулю. При более высоких концентрациях СО2 фотосинтез постепенно насыщается потому что его начинают лимитировать другие факторы кроме CO2. |
CO2 – самый важный источник питания для растений.
CO2 вне всякого сомнения является самым важным питательным веществом для растений потому что его роль в фотосинтезе в конечном счете приводит к формированию новых листьев и корней. Фотосинтез это процесс происходящий только у фотоавтотрофов - организмов которые могут жить используя свет как источник энергии. В процессе фотосинтеза СО2 и вода H2O при помощи света преобразуются в богатые энергией сахара C6H12O6 и кислород O2.
Из уравнения фотосинтеза очевидно что для его протекания нужны только CO2, вода и энергия света. Следовательно если одного из трех главных компонентов будет недостаточно, фотосинтез происходить не будет. Это кажется странным потому что мы все знаем людей которые могут отлично содержать красивый аквариум с растениями без искусственной подачи CO2.
Значит СО2 должен был изначально присутствовать в воде или это было бы невозможно. В биосистемах СО2 образуется в процессе дыхания. Можно сказать что процесс дыхания противоположен процессу фотосинтеза. В процессе дыхания высвобождается энергия при преобразовании сахаров в СО2 и воду. Водные растения тоже дышат все 24 часа в сутки. Тем не менее, при освещении большинство водных растений потребляют намного больше органического углерода в процессе фотосинтеза, чем выделяют в процессе дыхания. Однако ночью фотосинтеза нет потому что нет света, поэтому дыхание доминирует и СО2 производится растениями, беспозвоночными, рыбами и микроорганизмами.
Врезка 1
Когда СО2 растворяется в воде, согласно уравнения он образует равновесие между угольной кислотой H2CO3, бикарбонатом HCO3- и карбонатом CO32-:
Уравнение 1 H2O + СО2 <->* H2CO3 <-> H+ + HCO3- <-> H+ + CO32-
Из базовых законов химии следует что СО2 потребляется в процессе фотосинтеза растениями, а pH повышается потому что из раствора удаляются протоны. Протоны удаляются потому что равновесие стремится в левую сторону когда СО2 пополняется из (HCO3-) и карбоната (CO32-). Знак * обозначает что этот процесс часто стимулируется carbonic anhydrase, энзим который в процессе эволюции жизни на Земле образовывался у растений и животных несколько раз. С другой стороны ночью, когда доминирует дыхание, pH понижается потому что образуется больше протонов и СО2 постоянно добавляется в левую часть уравнения. |
|
CO2 как функция pH. При низком pH большинство неорганического углерода присутствует в форме CO2. При нейтральном pH большинство его присутствует в форме бикарбоната, а при высоком pH уравнение смещается в сторону карбоната.
Сумма бикарбоната и карбоната называется карбонатной жесткостью и измеряется в градусах (dKH). Лучший и более корректный термин это карбонатная щелочность которая измеряется в миллиэквивалентах на литр (meq/l). Милли эквивалент показывает сколько миллиэквивалентов кислоты требуется для титрования бикарбоната и карбоната которые оба действуют как слабые щелочи.
|
После того как СО2 диффундирует в клетки и далее в хлоропласты где и происходит фотосинтез он преобразуется в процессе фотосинтеза из неорганического углерода (двуокись углерода, CO2) в органический углерод (сахар, C6H12O6) по формуле 2:
Формула 2 6CO2 + 12H2O -> 6C6H12O6 + 6 O2
Формула 2 слишком упрощена и на самом деле содержит несколько химических циклов. Останавливаться на каждом из них вне темы данной статьи. Тем не менее важно отметить что этот процесс требует энергии света и следовательно происходит только во время освещения. Первый этап фотосинтеза это захват CO2, когда карбоксилаза, RuBisCO выступает катализатором длинной цепочки биохимических процессов. Как и все энзимы, RuBisCo состоит из протеинов и следовательно содержит большое количество органического Азота [N]. Это та причина по которой мы наблюдаем четкое взаимодействие между CO2, питательными веществами и светом как описано во всей этой статье. |
Химия воды и СО2
Растворимость СО2 очень высока и он легко растворяется в воде. Растворимость почти 1:1, что означает что 1л воды может содержать почти такое же количество СО2 как и 1л воздуха в равновесном состоянии. Когда СО2 растворяется в воде он образует равновесие между угольной кислотой (H2CO3), бикарбонатом (HCO3-), и карбонатом (CO32-), см. Врезку 1. Баланс между двуокисью углерода, бикарбонатом и карбонатом очень зависит от pH, то есть при низком pH двуокись углерода доминирует а бикарбоната и карбоната практически нет, в то время как при нейтральном pH бикарбонат доминирует над двумя другими формами углерода. Только при высоком pH существует доминирование карбоната. Из этих фактов мы можем получить определенную выгоду и делать pH на уровне который устраивает нас, тем самым получая желаемую концентрацию СО2 в аквариуме с растениями.
 | CO2 питает фотосинтез, а O2 является побочным продуктом. Если в воде присутствует достаточно СО2 многие растения образуют пузырьки кислорода. Здесь Riccia fluitans покрыта тысячами пузырьков.
Потребление водными растениями двуокиси углерода.
Все водные растения потребляют СО2 непосредственно из воды. Когда наземные растения потребляют СО2 из окружающего воздуха они это делают через устьица. Настоящие водные растения не имеют устьиц и толщина кутикулы меньше по сравнению с их наземными родственниками. Следовательно когда водные растения потребляют СО2 из окружающей воды они делают это путем пассивной диффузии СО2 из воды через небольшой слой кутикулы в фотосинтезирующие клетки. У водных растений даже клетки эпидермиса содержат хлоропласты чтобы уменьшить расстояние которое должен пройти CO2.
|
В воде потребление СО2 ограничено низкой скоростью диффузии. Диффузия газов в воде почти в 10.000 раз медленнее чем в воздухе. Мы можем частично это компенсировать повысив в аквариуме с растениями концентрацию CO2. Однако в большинстве случаев мы можем повысить концентрацию до в 100 раз большей чем установившееся равновесие между воздухом и водой, что означает что водные растения все равно будут лимитированы низкой скоростью диффузии газов в аквариуме. Есть альтернативные пути фотосинтеза и альтернативные источники CO2, включая использование бикарбонатов которое описано во Врезке 2.
Взаимодействие с другими питательными веществами и светом.
Большая подача СО2 может помочь растениям сохранить другие важные питательные вещества, и если СО2 много, водные растения могут расти даже при меньшей интенсивности освещения. Этот феномен был описан в TAG 2001, когда использовалась подводная форма Riccia fluitans. Вкратце, наше исследование показало, что повышенные концентрации СО2 в аквариуме могут поддерживать такой же рост растений при меньшей интенсивности освещения и доступности азота. Мы пришли к выводу что часто проще сделать большую концентрацию СО2 в аквариуме чем увеличить освещенность и рекомендуем ориентироваться на высокие значения во Врезке 3, особенно если аквариум еще не имеет интенсивного освещения.
Другой аспект взаимодействия между СО2 и другими питательными веществами заключается в том что их концентрация может быть понижена без потери выгод подачи CO2. Высокие уровни СО2 в аквариуме позволяют растениям использовать меньше азота для Rubisco¬, который является самым распространенным энзимом растений. Rubisco это энзим который выступает катализатором первого этапа Цикла Кальвина когда СО2 соединяется с рибулозо 1-5 дифосфатом. Все энзимы состоят из протеинов которые содержат очень много Азота. Следовательно если при высокой концентрации СО2 нужно меньше энзимов протеины могут использоваться в других процессах ведущих к образованию новой биомассы. (1)
|
Littorella uniflora выращенная при высокой и низкой концентрации CO2. Растения выращенные при высокой концентрации СО2 были намного больше при том что питательных веществ поступало равное количество.
(слева высокая, справа низкая подача CO2)
Подача в аквариум с растениями CO2.
Если у вас есть компрессор, выключите его! Если у вас есть два компрессора, выключите их оба! В аквариуме с растениями компрессор не используется никогда. Назначение компрессора подавать кислород (O2) рыбам и беспозвоночным в аквариум в котором нет стабильного производства кислорода водными растениями. В аквариуме с растениями кислорода будет более чем достаточно как для рыб, так и для беспозвоночных даже в ночное время когда фотосинтез не происходит. Во время ночного дыхания растения, рыбы и беспозвоночные производят СО2 который легко растворяется в воде. Этот СО2 может использоваться растениями во время фотосинтеза когда на следующий день включается свет. Если включен компрессор СО2 выветривается из воды, так же как углекислота выходит если встряхнуть бутылку с газированной водой. Таким образом лучше отправить компрессор на давно заслуженный покой!
|
Чтобы поддерживать требуемую концентрацию СО2 в аквариуме мы рекомендуем использовать постоянный CO2-тестер. Это маленькое гениальное устройство помещается в аквариум и наблюдается снаружи. В нем применяется цветной химический индикатор (бромотимол голубой¬, bromothymol blue), который всегда должен быть зеленого цвета если концентрация СО2 находится в рекомендуемом диапазоне. Вообще то это устройство показывает не концентрацию СО2 а pH, таким образом оно может использоваться только как указатель того что СО2 точно сколько нужно. Таблица dKH/pH в этой статье показывает концентрацию СО2 при данном pH как функция карбонатной жесткости dKH. Постоянный СО2 тестер просто несложный способ проверки уровня СО2 (pH) а не самого внесения СО2 как такового. (2)
Если требуется поднять концентрацию СО2 в аквариуме с растениямиМетод брожения¬ вероятно самая дешевая альтернатива. Метод брожения основан на том что клетки дрожжей в отсутствие кислорода ферментируют сахара или крахмал в CO2. Полученный газ СО2 подается в воду при помощи керамического распылителя, механического распылителя, или при помощи CO2-реактора. Побочным продуктом ферментации является алкоголь (в нем может быть и метанол, так что не пейте его!). В Интернет можно найти множество реализаций хорошо функционирующих емкостей для брожения. Они также производятся и продаются в аквариумных магазинах. Конечно метод брожения лучше чем ничего, но у него есть один большой недостаток – подача газа не может быть контролируемой. Иногда дрожжам всего хватает и они ферментируют много сахара что приводит к огромному растворению СО2 в воде. В другое время клетки дрожжей менее активны и в аквариум подается слишком мало CO2. Многие думают что подобные колебания концентрации СО2 в воде приводят к таким же колебаниям pH что отрицательно сказывается на беспозвоночных, рыбах, и даже растениях. В некоторых случаях это может иметь место, но в природе в реках и озерах может быть до 20мг/л СО2 утром и только 5мг/л ночью, хотя он постоянно поступает из богатых СО2 грунтовых вод. Растения, беспозвоночные и рыбы прекрасно живут при таких резких ежедневных колебаниях СО2 в течение суток. Однако некоторые беспозвоночные и рыбы могут быть чувствительны к таким большим изменениям pH, так что перед установкой бродилки следует проверять в литературе их чувствительность к колебаниям pH. (3)
Врезка 2
Некоторые водные растения могут использовать бикарбнат (HCO3-) если недостаточно CO2. В воде с достаточной карбонатной щелочностью бикарбонат (HCO3-) присутствует в больших количествах при pH от 7 до 10 (см. Врезку 1). С другой стороны, когда pH выше 8 газообразного СО2 очень мало независимо от карбонатной щелочности, таким образом водные растения которые могут потреблять бикарбонат как источник неорганического углерода имеют большое конкурентное преимущество перед теми что используют только CO2. Потребление бикарбоната водными растениями сама по себе целая наука, но как это работает для большинства растений использующих бикарбонат могут объяснить две простые модели. Одна модель впервые предложенная Prins и Elzenga (1989) касается растений которые для использования бикарбоната имеют поляризованные листья. У этих растений протоны выходят на нижней стороне листа (abaxial side) что приводит к очень низкому pH вплоть до 4. здесь бикарбонат преобразуется в СО2 который далее диффундирует в листья где используется при фотосинтезе. Негативный заряд в форме hydroxil ions выбрасываются на верхней стороне листа (abaxialside) где pH поднимается выше 10. Иногда высокий pH приводит к выпадению на поверхности листьев карбоната кальция, придавая растениям беловатый вид. Хороший пример растений использующих бикарбонат это Elodea canadensis, Egeria densa и большинство видов прудовых быстрорастущих длинностебельных растений. |
|
При интенсивном фотосинтезе pH на поверхности листьев повышается и в некоторых случаях может привести к выпадению карбоната кальция. Здесь, биогенный карбонат кальция сформировался на листьях Анубиаса.
|
Другие растения использующие бикарбонат не имеют поляризованных листьев, например некоторые виды Vallisneria. Они используют бикарбонат через листья перекачивая ионы и преобразуют его в СО2 уже внутри листьев. Независимо от модели, потребление бикарбоната энергоемкий процесс и даже эффективные потребители бикарбоната не производят энзимы если они не нужны. Так, в среде с изобилием СО2 эти потребители бикарбоната не могут использовать бикарбонат не пройдя период адаптации с низкой концентрацией СО2 в воде в течении которого производятся необходимые энзимы. Одним из самых важных энзимов для растений использующих бикарбонат является carbonic anhydrase который катализирует медленное формирование угольной кислоты из воды и СО2 и наоборот, что является критичным моментом при обратном переходе с потребления бикарбоната на потребление СO2 (см. Врезку 1).
У водных растений есть несколько других способов компенсировать медленное растворение СО2 в воде. Один из них - использование C4-фотосинтеза который является очень распространенным типом фотосинтеза для наземных растений. Кукуруза наиболее известный тому пример. В C4-растениях производство кислорода пространственно отделен от процесса фиксации CO2. Такие растения могут фотосинтезировать при пониженных концентрациях СО2 потому что кислород в тканях хранится отдельно от Rubisco. Если вокруг Rubisco будет слишком много кислорода он становится очень малоэффективным потому что Rubisco преобразуется в oxyganase приводя к фотодыханию и потере органического углерода. Фотосинтез C4 был обнаружен только у одного вида водных растений (Hydrilla verticillata) и похоже там он работает без Kranz anatomy который всегда является характерным для наземных C4-растений. Другая стратегия которая может компенсировать медленное растворение СО2 это фиксация СО2 полученного в фазе ночного дыхания CAM-растениями. Здесь СО2 захватывается в malate ночью, а затем выпускается как СО2 когда есть свет.
И наконец, некоторые водные растения приспособились использовать для фотосинтеза СО2 из донных отложений. Здесь СО2 диффундирует из донного осадка, где он всегда присутствует в высоких концентрациях в корни и через aerenchyma далее вверх к листьям, где фиксируется в процессе фотосинтеза. Ранее считали, что это может быть важным только для водных isoetids (Lobelia dortmanna, Littorella uniflora и некоторые виды Isoetes), но недавние исследования Andres Winkel из Freshwater Biological Laboratory показали, что СО2 полученный из донного осадка важен и для фотосинтеза Vallisneria americana.
|
|
Эта модель показывает как работает потребление бикарбоната на поляризованных листьях.
Фотоны выбрасываются из листьев и подкисляют abaxial (нижнюю) поверхность листа где бикарбонат преобразуется в CO2. Adxial (верхняя) сильно щелочная сторона листа часто приводит к выпадению на ней карбоната кальция.
|
Различные известковые таблетки, которые попадая в аквариум растворяются и выделяют CO2, тоже могут использоваться как источник CO2. У нас не было личного опыта использования таких продуктов, но вы можете найти самые разные наблюдения в Интернет о положительном или нулевом эффекте внесения в аквариум с растениями таблеток карбоната кальция. Несколько лет назад был представлен CarboPlus¬. Он производит СО2 методом электролиза из твердого угольного блока и при хорошо буферизированной воде в аквариуме (карбонатная жесткость dKH8-12) работает довольно хорошо.
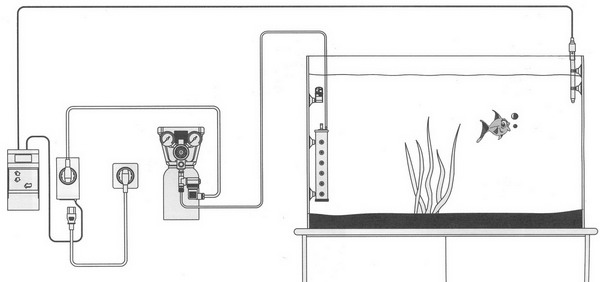 | Диаграмма показывающая различные элементы системы подачи СО2 с pH контроллером.
CO2 хранится в жидком состоянии в газовом баллоне с электромагнитным клапаном контролируемым pH-метром. pH-электрод находящийся в аквариуме постоянно снимаек показания pH. Если растения потребляют СО2 pH поднимается, и pH-метр открывает клапан. СО2 подается в аквариум до тех пор, пока pH не достигнет заданного значения на pH-метре, что заставляет pH-метр закрыть клапан (диаграмма Dupla Aquaristick, Germany). |
Сжатый CO2¬ - наилучшая альтернатива методу брожения¬. Хранящийся в баллоне СО2 находится в жидком состоянии под давлением около 58 бар. СО2 можно подавать от разных баллонов которые не обязательно должны быть адаптированы к подаче газа в аквариум потому что СО2 используется и для приготовления газированной воды (напр. SodaStream), сварки, или для системы подачи пива из кегов. В принципе, все эти системы можно использовать для аквариума, но на практике нас ограничивает резьба на газовом редукторе. Самая простая система подачи СО2 от баллона состоит из газового баллона, понижающего газового редуктора с манометром и регулятором низкого давления соединенного с керамическим или механическим распылителем, или CO2-реактором. Часто дискутируют стоит ли отключать подачу СО2 на ночь. Как объяснялось выше, дыхание множества растений, беспозвоночных и рыб могут сглаживать колебания концентрации CO2, так что отключение подачи СО2 ночью преимущественно ставит своей целью избежать лишнего расхода СО2 когда растения не могут его использовать для фотосинтеза.
Более сложная система может включать электромагнитный клапан который отключает подачу газа ночью при помощи таймера. Самые сложные системы включают в себя pH-электрод и pH-метр который контролирует срабатывание электромагнитного клапана. Таким образом подача СО2 может контролироваться автоматически и включаться и выключаться в соответствии с заданным значением pH. Когда фотосинтез доминирует над дыханием, СО2 потребляется растениями и pH повышается. Когда pH достигнет значения выше заданного на pH-метре, pH-метр открывает электромагнитный клапан и СО2 подается в воду. Когда требуемая концентрация СО2 будет достигнута, pH упадет, и pH-метр даст сигнал электромагнитному вентилю выключить подачу CO2. Такая система экономит СО2 и поддерживает очень стабильный pH. Однако pH-электрод нужно регулярно калибровать чтобы предотвратить неправильное снятие показаний pH, что приводит к тому что концентрация СО2 будет очень далека от заданной (прим. перев.: выставленной на pH-метре).
В растительных нано-аквариумах для повышения концентрации СО2 использовали газированную воду (разумеется без лимона и сахара). Его не просто обслуживать и требуется время чтобы аквариум стабилизировался. Мы видели несколько примеров когда после слишком большой дозы газированной воды рыбы стояли у поверхности воды хватая ртом воздух с поверхности. Также, некоторые растения (напр. Криптокорины), могут быть чувствительными к резким изменениям pH, так что газированная вода как способ подачи СО2 должна использоваться с осторожностью. (4)
Недавно появились различные органические удобрения с углеродом. Мы тестировали два таких продукта на Hygrophyla carymbosa “Siamensis” (широко распространенное и популярно аквариумное растение потребляющее углерод только в форме CO2) и Egeria densa (еще одно распространенное аквариумное растение способное использовать бикарбонат) и наблюдали какого либо позитивного или негативного эффекта на фотосинтез измеренного в виде производства кислорода. Тем не менее, некоторые аквариумисты сообщали о положительном влиянии на рост растений при использовании органических источников углерода. Возможно требуется более детальное исследование для определения всех за и против этих продуктов.
|
Врезка 3
Почему растениям в аквариуме нужен CO2?
· CO2 один из трех компонентов фотосинтеза. Без СО2 растения не могут фотосинтезировать, следовательно это самый важный источник питания для растений.
· При фотосинтезе СО2 фиксируется в богатых энергией органических соединениях которые используются для поддержания всего метаболизма. Некоторые органические соединения используются для роста, следовательно СО2 нужен растениям для формирования новых листьев и корней.
Присутствует ли СО2 в аквариуме до его подачи в аквариум?
· CO2 всегда присутствует в аквариуме, но его концентрация часто слишком низка, что очень ограничивает рост.
· CO2 уже присутствующий в аквариуме поступает от дыхания растений, рыб и микроорганизмов.
· Уровень СО2 будет максимальным перед включением света, и самым низким в конце периода освещения. Это происходит потому что растения используют накопленный CO2, но его недостаточно чтобы питать фотосинтез дольше чем несколько часов.
Как подавать в аквариум CO2?
· методом брожения
· известковыми таблетками растворяющимися в кислоте
· электролитическим методом
· сжатый СО2 от баллонов (постоянная подача, или с pH-метром)
Прим. перев.: еще один источник СО2 для растений и одновременно альгицид - глутаровый альдегид¬.
Заметьте что соотношение между карбонатной жесткостью (dKH) и pH определяется концентрацией СО2 в воде. Например при падении pH с 8 до 7 в жесткой воде концентрация СО2 будет значительно больше, чем в мягкой.
Какая рекомендуется концентрация CO2?
· Без дополнительной подачи СО2 его уровень обычно составляет 5мг/л и даже минимальное увеличение приводит к заметному влиянию на растения. Мы рекомендуем 15-30мг/л.
· Заметьте что СО2 сам по себе тоже влияет на pH. Чем больше СО2 в воде, тем ниже pH. Водные растения легко справляются с pH вплоть до 6, в то время как рыбы и беспозвоночные могут быть более чувствительны.
|
| Эта таблица демонстрирует соотношение между карбонатной жесткостью (dKH) и pH.Цифры показывают концентрацию СО2 в мг/л. Для растительного аквариума мы рекомендуем концентрацию 15-30мг/л. |
Заключение
CO2 вне всякого сомнения является самым важным среди всех питательных веществ для растений, и именно поэтому в разумных концентрациях он должен присутствовать в растительном аквариуме. В общем случае СО2 полученного биологическим путем от дыхания недостаточно для поддержания стабильного фотосинтеза водных растений использующих только CO2. Так что чтобы выращивать более сложные и требовательные растения потребуется какой либо способ подачи CO2. В растительном аквариуме мы рекомендуем уровень СО2 15-30мг/л, хотя меньшие значения для большинства растений тоже дадут положительный эффект. Уровень значительно выше 30мг/л может иметь отрицательные последствия для беспозвоночных и рыб, так что нужно регулярно контролировать концентрацию СО2 поддерживая здоровый и безопасный уровень.
Попробуйте прямо сейчас и получайте удовольствие от процветания вашего аквариума!
Литература
Bowes G (1987) Aquatic plant photosynthesis: strategies that enhance carbon gain. In RMM Crawford (ed) Plant life in amphibious habitats, pp 99-112
Madsen TV & Sand-Jensen K (1991) Photosynthetic carbon assimilation in aquatic macrophytes. Aquatic Botany 41: 5-40
Prins HBA & Elzenga JTM (1989) Bicarbonate utilization: function and mechanism. Aquatic Botany 34: 59-83.
^
Прим. переводчика:
(1) Rubisco. Когда растения имеют доступ к большому количеству СО2 для его усвоения им требуется меньше рубиско и соответственно азота, но в случае временного уменьшения подачи СО2 (сбой в настройке баллонной системы, старая закваска в бродилке, плохая работа реактора и т.п.) растениям сразу же потребуется произвести больше рубиско и соответственно потребность в Азоте резко возрастет. По этой причине рекомендуется всегда поддерживать небольшой избыток NO3 по сравнению с PO4 (~1:15). Подробнее смотри в разделе Стабильность¬.
(2) Индикатор СО2 (dropchecker) действительно не показывает концентрацию CO2, - только pH на который влияет множество других факторов кроме собственно СО2 (гуматы, жесткость воды, примеси, растворенная органика и пр.). Индикатор легко превратить в постоянный тестер именно концентрации CO2¬ используя калиброванный раствор с dKH=4.000 и индикаторное вещество бромотимол голубой (bromothymol blue¬).
(3) Метод брожения не является таким же стабильным как подача СО2 от баллона, но совсем несложно минимизировать эти колебания и сделать подачу СО2 методом брожения простым и надежным методом.
Для этого используют:
1 - две емкости вместо одной,
2 - подкормку дрожжей макро- и микроэлементами
3 - распыление механическим диффузором,
4 - стабилизацию температуры бродилки.
Подробнее смотри в разделе метод брожения – лучшая практика¬.
(4) Газированная вода. Для нано-аквариумов значительно проще и надежнее использовать относительно новый препарат Seachem Flourish Excel™ (глутаровый альдегид¬).